

原発例のガイドラインとしては、2年毎のSt. Gallenの国際専門家会議の推奨指針がよく利用されています。ただ、このガイドラインはあくまで比較的早期の症例(Stage II期まで)に対するもので、進行再発例には適していません。その他、米国のガイドラインはインターネット上で閲覧可能でNCCN<http://www.nccn.org/>、ASCO<http://asco.org/>などのガイドラインが有名です。これらのガイドラインは原発例から進行再発例にまで適用できるように記載されています。いずれのガイドラインも英語表記ですので、医師以外は利用しづらいのが難点です。
日本では、国際的に用いられているstage分類とは別に独自の「乳癌取り扱い規約」によるstage分類が使用されていることもあり、施設間や論文における治療成績、特に欧米のTNM分類に基づくデータとの比較には注意が必要です。Stage分類がどの分類に基づくものか、さらに、触診、肉眼、画像所見に基づくものか、病理学的所見に基づくものかを区別しなければなりません。
また、治療成績は施設や治療医による格差が大きいこと、さらに、ガイドラインはあくまで総論で、標準的患者に対する標準的治療として推奨されるものであり、癌の生物学的特性や社会的背景や遺伝子学的背景が異なる個々の患者さんにとって最適治療であるかどうかは、別の問題であることも強調する必要があります。
以上の治療のガイドラインの基本になっているのが乳癌の生物学的特性で、この特性に応じた最適治療を行うことになります。この特性による分類をintrinsic subtype分類と呼びます。次の章でこれらについて説明します。
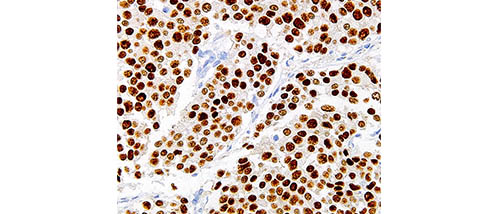
乳癌は、異なる分子生物学的特徴を示す数グループに分類され、それぞれ化学療法や内分泌療法の効果や予後が異なります。これらの分類をintrinsic subtype (形質分類) と呼び、本来は遺伝子解析により分類しますが、臨床上はエストロジェン受容体 (ER) 、プロゲステロン受容体 (PgR)、上皮細胞増殖因子受容体2 (HER2)の免疫染色により判定された分類を用います。
この分類は暫定的ですが、臨床上は臨床応用しやすいこの分類を用います。Subtypeは大きく5型に分類されます。ERとPgRの発現の有無により、ER(+)/PgR(+)はLuminal-AとBに、Luminal-Bはさらに2型に分類されます。ER(-)PgR(-)はHER2(+)のHER2型とER(-)、PgR(-)、HER2(-) のTN型に分類されます。TNは予後不良で、さらにBasal-like 型 とUnclassified 型に分類することもあります。TNの80%を占めるBasal-likeは基底/筋上皮細胞のマーカーであるサイトケラチン (CK) 5/6 やHER1 (EGFR)が陽性で、特に予後不良とされます。TNの本邦での頻度は10-15% 前後とされています。
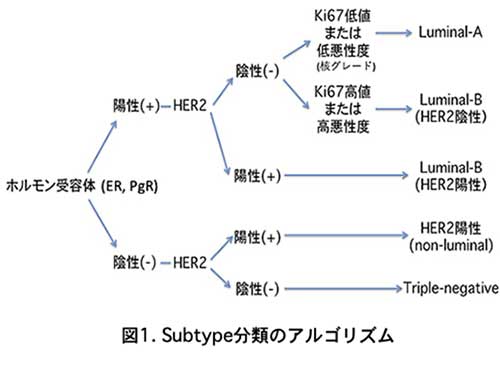
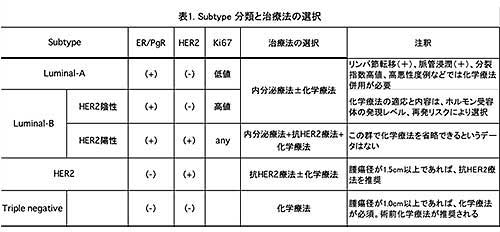
Subtype別の基本的治療方針は、以下のようになります。下の表は当院で用いている分類で、臨床に便利な様に改変したものです。
- (1) ER(+)であれば、内分泌療法(ホルモンを抑える治療)を行う。
- (2) HER2蛋白が過剰発現していれば、抗HER2療法を行う。
- (3) TNであれば化学療法 (抗癌剤) しか選択肢がない。また、術前投与が勧められる。
(subtype分類とは別に、BRCA mutation(+)の場合はオラパリブの投与が可能。また、PD-L1陽性であれば、免疫チェックポイント阻害剤の投与が可能。次項のトリプルネガティブ乳癌及び薬物療法を参照) - (4) ER(+)でも、Ki67指数 (増殖能) が高い、核grade (悪性度) が高い、リンパ節転移 (+)、脈管侵襲 (+)の場合、内分泌療法に化学療法を追加する。
- (5) Ki-67指数(増殖能)が高ければ、化学療法が奏効する可能性がある。
以上の治療法選択はあくまで目安にすぎず、進行度、特に転移の有無やその程度により変わります。
ただ、Subtype分類の基準になる各因子の(+)/(-)の基準がかなり曖昧です。例えば、E Rですが、学会発表を見ると、1%陽性でも(+)としている施設もあれば、10%以上陽性を(+)としている施設があります。1%陽性で(+)と判定するのは、内分泌療法はE Rが1%でもあれば、投与することが勧められているためでもあります。しかし、冷静に考えて見れば、1%や10%がER(+)でも残りの99%や90%はER(-)で、HER2が陰性であれば、99%や90%はtriple-negativeということになるのではないでしょうか。わずかしかない方を基準にしてSubtypeを判定しているのも変な話です。
HER2発現も曖昧です。HER2発現は、3+は抗発現で陽性、2+はFISH検査による遺伝子増幅の判定を行なって、遺伝子増幅があれば、陽性と判定される訳ですが、これは、抗HER2抗体を用いた(トラスツズマブとペルツズマブ)の適用基準として用いられています。しかし、最近発売された抗HER2剤であるエンハーツは、同じトラスツズマブに抗癌剤デルクステカンを結合させた抗体―抗癌剤複合体ですが、HER2発現が2+、1+の低発現例も適応となっています。同じトラスツズマブに抗癌剤エムタンシンを結合させたカドサイラは高発現例のみが適応です。エンハーツは抗HER2剤ですが、triple-negative例にも適応があるということになります。
その他にも色々曖昧な点がありますが、このsubtype分類は新しい治療薬の出現とともに、大きく変化していくものです。
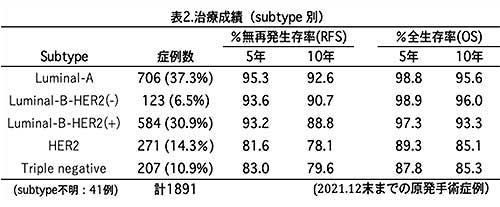
当院におけるsubtype別の治療成績を生存率で比較しました(表2)。Luminal群が74.7%、HER2群が14.3%、TN群が10.9%の割合でした。Luminal型3群の治療成績はほぼ同じで、LuminalーA群が最も良好で、Luminal-B-HER2(+)群の生存率が最も低い傾向にあります(統計学的有意差なし)が、最も良好なLuminal-Aと比較して、RFSにおける差は5年で2.1%、10年で3.8%、OSにおける差は、5年1.5%、10年で2.3%と僅かでした。HER2群とTN群の生存率は、Luminal群よりも有意に不良(p<0.0001)で、Luminal-群より約10%低下しますが、当院の場合、HER2群とTN群の生存率はほぼ同じでした。
乳癌の発生には、女性ホルモンと増殖因子が深く関与し、個々の乳癌とこれら因子との関係の指標としてエストロゲン受容体 (ER)、プロゲステロン受容体 (PgR)、上皮細胞増殖因子受容体2 (HER2)の3つがあります。一方、これら3因子とは無関係の乳癌があり、それが、ER (-)、PgR (-)、HER2 (-)のトリプルネガティブ (triple-negative, TN) 乳癌です。日本では10 - 15%の乳癌がTNと推定されています。
このTN乳癌は、
- 1. 比較的若い年代に多い
- 2. 腫瘍の増殖速度が速く、悪性度も高く、転移しやすい
- 3. したがって、早期再発が多く(1~3年がピーク)、予後が悪い、
などの特徴があります。
TN乳癌のうち、EGFR (HER1)やサイトケラチン5/6が陽性の Basal-like 型 が特に予後が悪いとされています。
治療は現在のところ、内分泌療法や抗HER2療法の効果がなく、化学療法 (抗癌剤)しか選択肢がありません。ただ、有効薬剤も未だ確定しておらず、試行錯誤の段階です。最近、各種の新薬が開発され、BRCA mutation(+)の場合にはリムパーザ(オラパリブ)が、PD-L1(+)の場合は免疫チェックポイント阻害剤のキイトルーダ(ペムブロリズマブ)とテセントリク(アテゾリズマブ)が使用可能となり、乳癌の90%以上で発現するTROP-2に対する抗体と抗癌剤の複合物であるトロデルビ(サシツズマブ・ゴビテカン)も新たに導入され、治療の選択肢が増えてきています。これらの薬剤については後述を参照。
乳癌の標準抗癌剤であるアントラサイクリン系(ドキソルビシン、エピルビシン)やタキサン系(パクリタキセル、ドセタキセル、アブラキサン)抗癌剤は、TN乳癌でも第一選択剤です。ただ、早期に耐性を獲得し、生存率や奏効率は不良といわれています。通常は、この2種の薬剤にシクロフォスファミド(エンドキサン)や5-FUなどを組み合わせて投与するAC→タキサン、FEC→タキサン等が代表的療法です
タキサンやアントラサイクリンが無効の時は、エリブリン (ハラヴェン)、ビノレルビン (ナベルビン)、ゲムシタビン、プラチナ製剤のカルボプラチンや経口剤のTS-1、カペシタビン (ゼローダ)などを組合せて投与します。
パクリタキセル+血管新生阻害剤アバスチンの併用も有効と報告されており、当院でも2〜3次治療に用います。ただ、経験上は、この2剤のみでは効果が低く、もう1剤 (エリブリンなど)の追加組合せが有効です。
TN乳癌にタキサン系抗癌剤やアントラサイクリン系抗癌剤を投与した場合、腫瘍が急速に増大することがあります。海外の論文で、乳癌におけるBackfire現象として報告がありますが、最近はbackfire現象とは呼ばないようです。当院でも数例の経験があり、今のところ、他のsubtypeではみられない現象です。直ちに薬剤の変更が必要なため、術前療法中は頻回に腫瘍サイズを測定する必要があります。原因として、抗癌剤が正常組織に損傷を与え、それを修復する為に増殖因子が放出され、抗癌剤抵抗性を誘導するという説があります。また、抗癌剤により腫瘍が壊死に陥った時、炎症性サイトカインであるIL-1αが放出され、これが腫瘍増殖の原因とする報告もあります。免疫チェックポイント阻害剤の投与で報告されている、投与後腫瘍が急速に増大する現象(Hyper Progressive Disease:HPD)も同様の現象かもしれません。乳癌以外の癌種でも見られ、他の抗癌剤でも見られるようで、TN乳癌で見られるのは、他のsubtypeと比較して術前療法が多く、腫瘍を観察する機会が多い為だと思われます。
抗癌剤は通常、再発予防を目的として術後に投与されます。他のsubtypeでは、リンパ節転移(+)、T2 (2-3cm以上)などが投与の条件です。しかし、TN乳癌では1cm以上であれば、リンパ節転移(-)でも投与が推奨されます。
また、TN乳癌では、手術前に投与する術前化学療法が推奨されます。他のsubtypeでは、2−3cm以上、リンパ節転移(+)の大きな乳癌を縮小させ、温存手術を行う目的で行われます。一方、TN乳癌では、サイズやリンパ節転移に関係なく、術前化学療法で癌を消失させて(完全奏効、pCR)から手術を行なうと、予後良好とされています。このため、このpCRを目指して投与します。通常は、AC→タキサン、FEC→タキサン等の療法を投与する事が多いようです。これらは強力な療法で、副作用も強く、脱毛も問題になります。当院では通院投与可能で副作用が少ない療法としてタキサンとアントラサイクリンを2 - 3週ごとに交互投与します。効果がない場合、ナベルビン、ゲムシタビン、エリブリンなどに変更します。脱毛が困る場合は、脱毛の少ないビノレルビンとゲムシタビンに5-FUを追加する組み合わせ (VGF療法)を用います。当院の経験では、タキサン+アントラサイクリンの併用療法と遜色ない効果が得られています。
経口剤の2剤併用カペシタビン+エンドキサンが有効との報告もあります。カペシタビンはドキシフルリジン(フルツロン)の改良型薬剤で、このフルツロンを含めた経口3剤併用DMpC療法(フルツロン+エンドキサン+ヒスロン)が有効との報告もあります。DMpCは副作用がほとんどなく、脱毛もありません。当院の経験では、pCR率は低いのですが、1ヶ月以上の投与で癌が縮小します。DMpCに通常のタキサン+アントラサイクリンを減量して併用するのも副作用が少なく有効な療法です。経験上は、フルツロンの代わりにUFTやTS-1を併用する療法も有効です。
その他、各種の新薬が発売されましたが、TNに多いBRCA変異陽性乳癌に投与されるリムパーザ(オラパリブ)は、少数例の経験ですが、副作用が少なく、従来の化学療法が無効の症例にも有効のようです。BRCA変異陽性は乳癌全体の約1割にしかみられないため適応となる人が少ないのが現状です。
免疫チェックポイント阻害剤のテセントリクやキートルーダも効果が期待される薬剤で、抗癌剤と併用で投与されます。特にTN乳癌に対する術前療法に用いると著効を示すことが多い様です。当院の少数例の経験では、再発例の2―3次療法では、効果が低いようです。また、副作用の問題から投与可能施設が制限され、従来の抗癌剤とは異なる副作用に注意が必要です。
新発売のトロデルビ(サシツズマブ・ゴビテカン)は、乳癌の90%で高発現していると言われる細胞表面のT R O P-2というタンパク質を標的とする抗体サシツズマブに抗癌剤イリノテカンの誘導体ゴビテカンを結合させた複合物です。2次治療以降のT N B Cの治療に用いられます。頻度の高い副作用としては、骨髄抑制、下痢などがあります。まだ少数の再発例での経験ですが、良い感触を得ています。
転移性T N B Cに対する化学療法に関する数万例を対象とするメタ解析(多数の臨床試験のデータを合わせて解析)の報告では、1次治療として最も有効であったのは、パクリタキセル+血管新生阻害剤アバスチンの併用で、プラチナ製剤を中心とした多剤併用療法も有効であるが、強い毒性が問題である。リムパーザ(オラパリブ)や免疫チェックポイント阻害剤のテセントリクやキートルーダ+化学療法も、パクリタキセル+アバスチンとほぼ同等の効果であった。2次治療以降では、トロデルビが最も有効で、次いでリムパーザ(オラパリブ)が有効であった。その他、2次治療以降の有用な薬剤として、アブラキサン、ゼローダ、エリブリンがあげられている。
また、別のメタ解析の論文報告でも、トロデルビは2次治療における確立された有効薬剤であるとされ、エンハーツは、評価するにはまだエビデンス不足とされています。
以上の様に、TN乳癌では抗癌剤の投与が必須となります。当院の経験では、TN乳癌では、再発後の投与では効果が低いため、術前投与や術後早期の予防的投与が大切と考えます。
当院では2023.12までに230例のT N B Cの手術を行なっております。
TN乳癌の術後生存率を表3に示します。
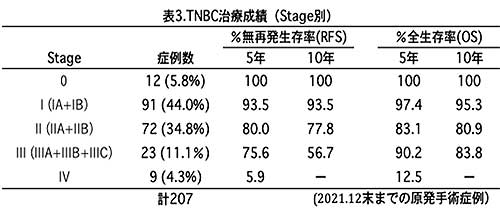
Stage 0とIの治療成績は他のsubtypeと比較してさほど差がありませんが、Stage II以上で治療成績が悪くなります。特にStage IVでは10年生存がでていません。
転移のあるStage II以上では、通常、術後に抗癌剤が投与されますが、その再発予防効果がTN乳癌では十分ではないことを示しています。
ただ、Stage IIIA、IIBの治療成績は、RFSがStage IIA、IIBよりも不良にもかかわらず、OSはStage IIA、IIBよりも良好で、逆転現象が見られます。Stage IIICでは、R F SとOSの10年生存率に大きな乖離が見られ、再発後の治療が奏効して生存期間が延びている可能性があります。もう少し詳しい解析が必要ですが、TN乳癌でも、治癒切除後の転移再発に対しては、現状の化学療法でも、投与法や併用法の工夫で治療成績が向上する可能性が示唆されます。
診断時既に遠隔転移のあるStage IVに対しては、化学療法の効果がかなり低いことが示され、早期に遠隔転移をする癌は、生物学的悪性度がより高く、抗癌剤抵抗性がより強い可能性があります。
T N乳癌の転移・再発例の治療成績は現在解析中ですが、薬剤投与が多岐にわたるため、困難を究めております。